-
摘要:
原发性心脏血管肉瘤是起源于血管内皮细胞的软组织肉瘤,其发病率无明显性别差异,早期临床表现无特异性,多数患者首次就诊时即发现心包积液。肿瘤多位于右心房及心包,超声心动图是诊断心脏血管肉瘤的首选检查方法,多模态影像学检查对心脏占位的良恶性判断及鉴别诊断有重要意义。本文回顾性分析25例病理确诊为原发心脏血管肉瘤病例的临床表现和影像学特点。
Abstract:Primary cardiac angiosarcoma is a type of soft tissue sarcoma originating in vascular endothelial cells, without obvious gender differences in the incidence rate and specific early clinical manifestations, whilstpericardial effusion often found at the first presentation of most patients. Tumors are mostly located in the right atrium and pericardium. Echocardiography is the preferred examination method for diagnosing cardiac angiosarcoma and multimodal imaging is important in the diagnosis and differential diagnosis of benign and malignant cardiac mass. This article retrospectively analyzes the 25 cases of clinical manifestations and imaging features of primary cardiac angiosarcoma.
-
Keywords:
- angiosarcoma /
- cardiac /
- echocardiography /
- imaging
-
原发性心脏肿瘤较罕见,其中25%为恶性肿瘤,常见为肉瘤,以血管肉瘤多见,约占所有心脏恶性肿瘤的95%[1]。原发性心脏血管肉瘤是罕见的起源于血管内皮细胞的软组织肉瘤,早期患者症状无特异性,有相应症状时多数已为病程晚期,且预后差。手术切除是局灶性肿瘤的主要治疗方法,完全手术切除可大幅提高生存率,尽管由于肿瘤的浸润性,获得阴性切缘较为困难。即使是局灶性肿瘤、结合多种治疗方法,局部和远处复发率仍然很高。目前全身治疗的顺序仍是积极研究的主题,更多的临床试验正在进行中,以扩大治疗选择和改善患者结局[2]。本文回顾分析北京协和医院(以下简称我院)经临床和病理明确诊断为原发性心脏血管肉瘤患者共25例,总结其临床和影像学资料,以期提高临床医师对这种罕见心脏肿瘤的认识。
1. 病例简介
利用基于医院信息系统(hospital information system, HIS)病历系统的搜索软件,搜索并整理了北京协和医院2018年1月至2022年6月期间,出院诊断为“心脏血管肉瘤”的患者共29例,其中原发于心脏、病理确诊为血管肉瘤且经超声心动图检查者共25例。回顾性分析患者详细临床资料、超声心动图检查结果,以及其他影像学检查(CT、MRI及PET/CT)结果,对上述数据进行分类分析,分类变量为频率计数和百分比,测量数据为中位数和范围。
临床特征:25例患者中,男12例,女13例,年龄14~74岁(中位年龄47岁)。临床症状主要包括胸闷气短(13例)、咳嗽咯血(7例)、胸痛(4例)、发热(4例)、心悸(2例)等多个症状。84%患者(21/25) 就诊时超声检查即显示心包积液,其中17例为中量至大量心包积液,临床表现为加重或突然出现的气短或端坐呼吸(8例)、血压降低及心率增快(2例)、意识丧失等急性或慢性心包填塞征象。行心包积液穿刺引流后,7例患者病程中表现为复发性心包积液。有2例患者临床无明显症状,为常规检查偶然发现(病例7、9)。
超声心动图检查:25例患者均经我院超声心动图检查,主要检查结果见表 1。部分患者就诊时,已在外院行心包穿刺引流等治疗,但未确诊。超声心动图显示,血管肉瘤分别位于右心房壁与右心房腔(11例)、心包(8例)、右心房及心包(3例)、房间隔(1例)、右心室(1例)。右心房占位36%(4/11)表现为中低回声,36%(4/11) 为中等回声,27%(3/11)仅表现为右心房壁增厚(病例14、21、23)。部分肿瘤导致三尖瓣口血流梗阻(病例8)和侵犯三尖瓣瓣环(病例17、22)。肿瘤位于心包的患者中有7例合并中至大量心包积液,其中2例通过经食道超声心动图发现心包内中低回声占位(病例6)或右心房壁增厚(病例23),5例病变与房壁分界不清,1例心包内肿瘤致右心舒张受限(病例16)。1例房间隔病变同时侵犯左右心房,合并瓣膜浸润致二尖瓣及三尖瓣的重度关闭不全(病例24)。1例右心室肿瘤侵犯三尖瓣瓣环,并导致右心室流出道梗阻(病例25)。3例肿瘤为多发,表现为右心房或心包内散在分布的占位(病例2、11、19),其中1例(病例19)右心房内的肿瘤呈不规则团块状附着在右心房壁至三尖瓣瓣环,随三尖瓣启闭在右心房室间移动。还有1例在超声心动图上未发现异常,通过CT检查发现位于心包的占位(病例5)。
表 1 原发性心脏血管肉瘤的超声心动图表现Table 1. Echocardiographic manifestations of primary cardiac angiosarcoma患者编号 肿瘤部位及大小(mm) 肿瘤回声及形态 肿瘤活动度 首次发现时心包积液量(外院) 本次入院时心包积液量 心脏腔室大小 其他 1 右心房;72×41 中低回声团块 不详 中量 中量 右心房增大 占位内可见血流信号,缩窄性心包炎改变 2 心包;17×9,29×18 低回声团块,不规则中等回声团块 不详 大量 中量 左心房增大 无 3 心包;40×62 不均匀回声团块 不详 引流出350 mL血性积液 微量 正常 右心房侧壁受压 4 右心房顶外心包内近右心房室沟;54×20 中等回声团块 不详 引流出700 mL积液 少量 左心房增大 占位似浸入右心房内 5 NA NA NA NA 中量 正常 无 6 右心房及心包;49×25 中低回声团块 不详 大量 无 不详 占位内血流丰富 7 右心房内、升主动脉周围;69×46 中低回声不规则团块,内见多发无回声区 低 NA 无 双房增大 占位与周边组织粘连 8 右心房内附着于右心房侧壁;29×18 中等回声、不规则分叶状团块 较大 大量 少量 正常 占位向心房外浸润生长;三尖瓣轻度梗阻 9 右心房顶及侧壁;63×35 不均匀回声团块 不详 少量 少量 正常 累及右心房室沟 10 右心房后侧壁外心包腔内;57×31 中等回声不规则团块 不详 不详 大量 正常 致右心房受压变形 11 右心房内上腔静脉周围,75×45;主动脉及肺动脉根部 中强回声、不均质团块 不详 大量 微量 双房右心室增大 无 12 右心房、右心耳内;29×47 中低回声团块 固定 大量 无 正常 与房壁关系紧密 13 右心房外心包内;69×54 中等回声团块 不详 大量 大量 正常 占位与右心房关系紧密;心包填塞 14 右心房壁增厚13;右心房室侧壁占位,最宽处26 中强回声 低,附壁 大量 微量 正常 右心室收缩功能减低 15 心包占位;58×24 中低回声及无回声、不规则占位 不详 少量 微量 正常 占位侵犯右心房,占位内低回声区血流与右心房交通;右心室收缩功能减低 16 心包腔内右心房顶部;53×35 囊实性团块 不详 少量,2 d后急诊穿刺100 mL血性心包积液 微量 正常 右心舒张受限 17 右心房侧壁;37×25 中低回声 不详 无 无 正常 占位侵犯三尖瓣瓣环;曾行肿瘤切除,此次复发 18 心包、右心房;58×52 中等回声团块 较大 大量 少量 正常 侵犯右心房侧壁向右心房生长 19 右心房,78×29;右心室流出道,47×15 中等回声团块 较大,随三尖瓣启闭移动 无 无 正常 与三尖瓣前叶关系紧密 20 心包;50×49 不均匀回声 不详 不详 少量 正常 占位向右心房内生长 21 右心房;最厚处28 中等回声,弥漫不规则改变 低,附壁 无 无 右心房增大 无 22 心包、右心房;83×56 中等回声团块 不详 大量 少量 无 心包局部粘连;占位压迫右心房侧壁,侵犯三尖瓣前叶瓣环;占位内血流丰富 23 右心房壁增厚; 6×26 中等回声 低,附壁 大量 大量 无 心包填塞 24 附着于房间隔累及左右心房;49×30 中低回声团块 固定 无 无 双房左心室增大 占位侵犯二尖瓣及三尖瓣瓣环,重度二、三尖瓣关闭不全 25 右心室;49×42 中等回声、不规则分叶状 不详 少量 少量 右心增大 占位致右心室流出道梗阻并侵犯三尖瓣,三尖瓣中-重度关闭不全;右心室收缩功能减低 NA表示不适用 声学造影检查:共2例,其中1例心包的占位病变内未见微泡显影(病例13),另1例结果提示心包内为中等血供占位(病例10)。
其他影像学表现:20例患者行CT平扫,其中7例为软组织密度或等密度影,6例表现为不均匀密度,3例为低密度,2例为高密度,2例为外院检查未溯源到肿瘤密度信息。15例患者行CT增强扫描,其中5例表现为明显强化,1例中度强化,1例轻-中度强化,3例轻度强化,1例片状不均匀强化,4例强化不明显。4例CT增强扫描见心包呈不均匀结节样增厚。4例患者CT检查发现肿瘤与冠状动脉分界不清(病例2、6、18、20),3例可见肿瘤血供来源为右冠状动脉小分支(病例10、18、20)。5例患者可见肿瘤转移至肺,表现为斑片状或条索样结节,呈实性或磨玻璃密度,内可见空泡影,增强后明显强化。见表 2。
表 2 原发性心脏血管肉瘤的其他影像学表现Table 2. Other imaging features of primary cardiac angiosarcoma患者编号 CT CMR PET/CT 肿瘤部位及密度 增强扫描 肿瘤部位及大小 信号强度及增强扫描 肿瘤位置大小及SUV值 转移部位 1 无 无 无 无 无 无 2 右侧房室间沟; 不规则混杂密度影 轻度强化,与右心房室及右冠状动脉中段分界不清,纵隔转移,胸膜转移 无 无 右侧心包内略低密度肿块SUVmax 10.4,心包横窦内及升主动脉后方均可见软组织密度灶SUVmax 12.2 肺,纵隔淋巴结 3 右心房;密度不均 无 无 无 心包内软组织密度影,形态不规则,内见坏死,6.5 cm×7.1 cm×5.9 cm放射性摄取环形增高,SUVmax 7.2 肝脏,甲状腺 4 无 无 无 无 右心房内软组织密度,2.8 cm×5.4 cm×8.3 cm,SUVmax 4.7 无 5 升主动脉右心房间;类圆形稍高密度影,平扫CT值44 HU 未见明显强化 右心房室沟、升主动脉右侧、右冠状动脉后方;6.3 cm×6.0 cm分叶状,侵犯右心房壁突向心包腔 T 1W、T 2W不均匀稍高信号 无 无 6 右心房;混杂软组织密度团块影,部分呈稍高密度 强化不明显,可见右冠状动脉小分支向病变内供血,病变与右冠状动脉中段、右心房关系密切 无 无 右心房形态不规则密度不均匀团块,SUVmax 1.9 颈部淋巴结 7 右心房前上方;低密度,与右心房边界欠清,平扫CT值38 HU 未见明显强化 无 无 无 无 8 右心房;形态欠规则分叶状,密度欠均边界不清 未见明显强化,心包局部增厚,双肺及胸膜多发结节灶伴空洞,代谢增高 无 无 右心房巨大软组织肿物,代谢增高 肺,胸膜 9 右心房;软组织团块影,边界不清 轻-中度强化,临近心包受累 无 无 右心房内不规则等密度灶并代谢增高,心包略增厚 无 10 右心房;密度不详,肿瘤为右冠状动脉分支供血 无 无 无 无 无 11 心包内升主动脉周围及肺动脉下方;密度不均匀,累及右心房右心室 无 纵隔内混杂信号影 T 1W不均匀低信号,T 2W不均匀高信号,增强扫描不均匀轻度强化,边界不清形态不规则 上纵隔10.0 cm×7.5 cm囊实性占位,包绕升主动脉,实性部分SUVmax 7.4 无 12 右心房心耳区;密度不详 不规则稍低强化灶,内见血管样强化 无 无 无 无 13 心包右侧;稍高密度 片状不均匀强化 心包内右心房外团片状占位,7.3 cm×5.4 cm,与右心房外侧壁及局部心包关系密切,右冠状动脉中段与占位分界欠清 T 1W混杂稍高信号,T 2W高信号,增强扫描不均匀片状强化,边缘强化较明显,局部心包可见强化 心包右侧,大小8.0 cm×5.0 cm×9.5 cm,SUVmax 30.2 无 14 右心房及右心耳外壁结节样不均匀增厚;软组织密度 明显强化,心包不均匀增厚伴异常强化 无 无 上腔静脉下段-右心房-右心耳3.4 cm×2.7 cm×3.6 cm代谢不均匀异常增高占位,SUVmax 18.3 双侧锁骨上区,上纵隔淋巴结 15 右心房、右侧心包;软组织密度 明显强化,病变累及右心房壁并向右心房腔内生长,双肺结节影伴强化 右心房前壁及下壁增厚可见软组织占位,向右心房腔内生长,边界较规则,最厚约20 mm 信号不均匀,T 1W低信号,T 2W高信号 心包内软组织肿块,SUVmax 14.8 双肺,纵隔淋巴结 16 心包;不规则软组织密度影 明显强化,双肺结节影,呈磨玻璃密度,内见空泡 无 无 右心房顶心包内囊实性软组织肿块,8.7 cm×4.2 cm,SUVmax 14.9 双肺 17 右心房前方;团片状软组织密度影,CT值31 HU 病灶内部斑片状不规则明显强化影,心包不规则增厚 无 无 术区、右心房内、右心耳旁、纵隔血管间隙不规则团块状及结节状高代谢灶SUVmax 8.7 无 18 右心房室交界处;混杂密度影,供血动脉为右冠状动脉小分支,病变包绕右冠状动脉中远段,心包不均匀结节状增厚 不详 无 无 右心内软组织肿块伴代谢增高 心包、主动脉弓旁、双肺下叶、右锁骨上多发转移淋巴结 19 无 无 无 无 无 无 20 右心房壁外心包内;软组织密度 明显强化,右冠状动脉分支供血,病变与上腔静脉及右冠状动脉局部分界不清 无 无 纵隔右侧不规则软组织肿块代谢异常增高 心包膜及胸部多发淋巴结转移 21 无 无 右心房侧壁不规则增厚并局部形成厚层占位突入右心房腔内,无明显活动度,与右心房壁分界不清,外缘光滑内缘不规则 内部为均匀等信号 无 无 22 无 无 无 无 心包软组织病变,3.3 cm×2.1 cm,SUVmax 7.3 无 23 上腔静脉下段、右心房内;等密度占位 混杂低强化,边界不清,与右心房后壁分界不清 上腔静脉下段及右心房壁近右心耳处 条片状等T 1、等T 2信号,增强扫描部分可见早期强化,心包增厚伴强化 上腔静脉至右心房局部密度增高灶,12 mm×24 mm×29 mm,SUVmax 10.5,延迟显像SUVmax 13.0 双肺,腋窝淋巴结 24 左心房下部不规则团片状低密度影,中心伴钙化影 中度强化,累及房间隔及右心房 无 无 无 无 25 右心室;不规则低密度影 无 无 无 右心室囊实性占位,4.4 cm×3.3 cm,4.3 cm×3.5 cm,SUVmax 22.6,心包积液SUVmax 1.5 无 CMR: 心脏核磁共振; PET/CT: 正电子发射计算机断层显像; SUVmax: 最大标准摄取值; T 1W: T 1加权像; T 2W: T 2加权像; NA表示不适用 部分患者进行心脏磁共振(cardiac magnetic resonance, CMR)检查,6例患者可溯源到报告内容,肿物呈团片状或分叶状,与心包及右心房分界不清,T1加权像2例为等信号,2例为混杂高信号,2例为不均匀低信号,T2加权像4例为高信号,2例为等信号。其中3例做过MRI增强检查,均可见肿瘤强化,还可见肿瘤边缘和心包强化。
21例患者手术前进行了PET/CT检查,部分可检索到较完整报告内容,检查见心包内放射性摄取不均匀异常增高的团块,其中8例表现为不均匀软组织密度影,3例表现为囊实性肿块,1例为略低密度,1例为等密度,标准摄取值(standard uptake value,SUV)范围4.7~30.2。1例(病例25)心包积液摄取值增高,SUV为1.5。10例患者可见肿瘤转移,其中6例转移到肺。
肿瘤大体形态及病理特点:25例患者均为低温体外循环全身麻醉下行肿物全部切除或部分切除手术,且均因右心房部分或完全受累进行了右心房重建术,术中探查肿瘤呈暗红色,质地脆(5例),易出血伴血栓样坏死物(6例),呈分叶状(1例)或菜花样浸润性生长(3例)。三尖瓣瓣环或瓣叶受累有10例,冠状动脉受累9例(其中8例累及右冠状动脉),房间隔受累6例,上腔静脉或下腔静脉受累6例,主动脉受累4例,左心房壁受累4例。
心脏血管肉瘤的免疫组化结果为CD34阳性23例,CD31阳性23例,ERG阳性19例,见表 3。有2例最终病理诊断为上皮样血管肉瘤。
表 3 心脏血管肉瘤的免疫组织化学结果Table 3. Immunohistochemistry result of cardiac angiosarcoma患者编号 性别 年龄(岁) 特征性病理免疫组化标志物 CD34 CD31 ERG Fli-1 SMA F8-R 1 男 25 + + + + + + 2 男 47 + + + + + + 3 女 47 + + + + + + 4 女 50 + + + + + + 5 男 43 + + + + + + 6 女 14 + + + + + + 7 女 61 + + + + + + 8 男 33 + + + + + + 9 女 33 + + + + + + 10 女 37 + + + + + + 11 男 57 + + + + + + 12 男 20 + + + + + + 13 女 51 + + + + + + 14 女 50 + + + + + + 15 女 32 + + + + + + 16 男 32 + + + + + + 17 女 24 + + + + + + 18 男 25 + + + + + + 19 男 74 + + + + + + 20 女 20 + + + + + + 21 男 70 + + + + + + 22 男 61 + + + + + + 23 女 55 + + + + + + 24 男 55 + + + + + + 25 女 53 + + + + + + 2. 讨论
心脏血管肉瘤属于恶性血管内皮瘤,它起源于血管内皮细胞或其前身细胞的恶性软组织肿瘤,组织学上由不规则形状的血管通道组成,瘤体内部伴有大面积的出血和坏死,肿瘤细胞表现出内皮细胞的形态和功能。发病率无明显性别差异,本研究中52%(13/25)的患者为女性,48%(12/25)为男性,诊断时的中位年龄为47岁(范围:14~74岁),与克利夫兰诊所报道的25年回顾性研究中[1]该病无性别差异、平均年龄50岁的结论一致。患者早期无特异性临床表现,随病程进展,可产生心包积液或肿瘤侵犯相邻组织导致胸闷、胸痛、咳嗽、心悸等症状[3]。仅靠临床症状很难诊断,因此影像学检查对于此类患者有重要诊断价值。
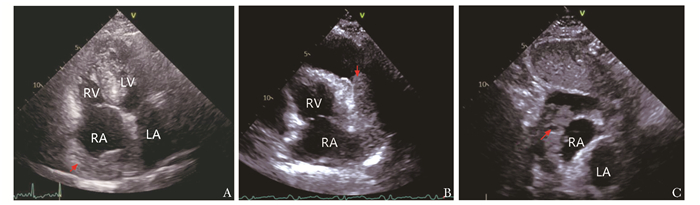
超声心动图凭借高敏感性和便捷性作为首选影像学检查方式,可动态观察心脏肿瘤的大小、形态、位置、瓣膜和心包受累情况、对血流动力学的影响及肿瘤良恶性的初步判断。原发性心脏血管肉瘤的超声心动图表现为常见于右心房及心包内形态不规则的中低回声团块,内部回声欠均匀,基底宽,无包膜,呈浸润性生长,与周围组织分界不清,活动度小(图 1),容易合并心包积液。本研究结果显示,92%(23/25)的原发性心脏血管肉瘤好发于右心房(11例)及心包(9例),另3例为右心房及心包同时受累。肿瘤可以侵犯冠状动脉、上下腔静脉及主动脉,也可以浸润三尖瓣、房间隔,84%(21/25)的患者就诊时即发现心包积液,其中33%(7/21)的患者病程中反复出现大量血性心包积液。本研究中88%(22/25)的患者经胸超声心动图可发现心脏占位,有2例患者大量心包积液时未发现占位,心包积液引流后行经食道超声心动图发现右心房-上腔静脉紧贴房壁的弥漫性占位或右心房壁增厚,结合经食道超声心动图对肿瘤的检出敏感性可达96%(24/25)[4]。声学造影也可作为经胸超声心动图的补充检查,文献报道,因恶性肿瘤血供丰富,声学造影时,与邻近心肌相比,恶性肿瘤的强化程度更高[5]。本研究中1例患者声学造影可见心包内肿瘤回声高于心肌,肿瘤内部有中量微泡显影,提示为中等血供占位。
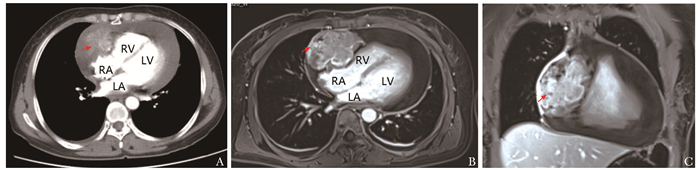
超声心动图可以有效发现心包积液,但对于心包占位及与周围组织的毗邻关系观察欠佳。CT可以从多切面观察肿瘤的形态、与周围组织的关系及心包情况,能够更敏感地发现肿瘤的出血和钙化;冠状动脉CTA可观察肿瘤与冠状动脉的关系,观察肿瘤的血供来源,可以预估术中是否需要进行冠脉旁路移植。本研究中CT检查显示39%(7/18)的心脏血管肉瘤表现为软组织密度,33%(5/15)增强扫描可见明显强化(图 2A)。此外,CT还可发现心脏血管肉瘤肺部转移所致肺内大小不等的散在分布的条索样结节,增强扫描可见明显强化。既往研究显示[6],CT平扫时血管肉瘤表现为均匀或不均匀的软组织密度,增强扫描表现为不均匀强化。中心区域表现为软组织密度、周围环绕着毛玻璃衰减晕圈,此为肺血管肉瘤的常见影像学表现[7-8]。
MRI能够更好显示软组织的特征,可以更好地显示出心脏内占位。此外,MRI允许在多个平面中成像,并可以提供一些功能信息,如大血管中的流动方向和流速[9]。对于患有肺部疾病或肥胖患者,超声心动图观察效果不佳,MRI可以观察到肿瘤的位置和大小,显示肿瘤本身的信号强度、肿瘤与周围组织的关系。因肿瘤中心区域坏死出血导致组织含水量不同,在T1上表现为具有多个高信号结节区域的等信号病变,通常被描述为“花椰菜”外观,T2通常表现为高信号。首过灌注表现为肿瘤中心坏死出血区无增强,外周为明显的血管强化影,通常描述为具有“阳光”外观[6, 10]。本研究中83%(5/6)的肿瘤呈混杂信号且增强期可见强化(图 2B~2C)。
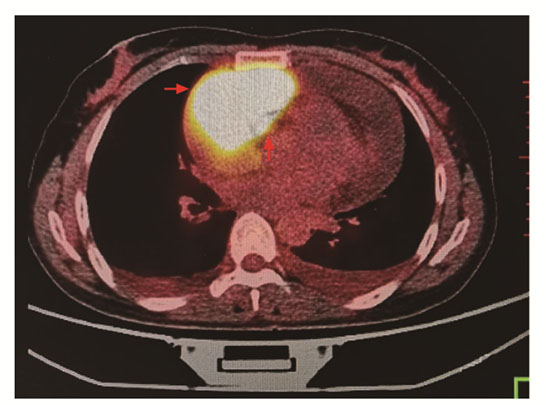
PET/CT在CT解剖成像的优势基础上加入功能显像,通过分子水平组织的葡萄糖代谢能力评估肿瘤的良恶性、判断是否发生全身转移,对手术和药物治疗方案的选择有重要价值。当最大标准摄取值(maximum standardized uptake value,SUVmax)>3.8时,诊断恶性肿瘤的敏感性可达93.1%,特异性达93.3%[11-12]。本研究中血管肉瘤的SUV值范围4.7~30.2,肿瘤摄取明显增强,均符合恶性肿瘤表现(图 3)。PET/CT费用昂贵且辐射剂量大,不宜作为常规检查,对临床高度怀疑肿瘤而普通检查观察欠佳,或恶性肿瘤患者观察全身转移情况时,可考虑行PET/CT。根据每例患者的特征和临床需求选择合适的成像技术,多种影像学检查相互结合可明确诊断。
继发性肿瘤是更为常见的心脏占位之一,发病率是原发性肿瘤的50倍,大多数心脏继发性肿瘤为恶性,最常见的是肺癌及乳腺癌,影像学很难鉴别心脏内占位是原发还是继发,有其他部位肿瘤病史,或看到其他部位肿瘤延续进入心腔内,则考虑为继发性肿瘤。心脏原发肿瘤中75%是良性肿瘤,最多见的是黏液瘤,超声心动图表现较典型,好发于左心房,其次是右心房,多为单发,大部分是椭圆形或圆形,呈分叶状,有包膜,无侵犯相邻组织表现,通常有蒂附着于房间隔,活动度与蒂的长短相关,蒂长的瘤体活动度较大,可造成不同程度的瓣膜或心腔梗阻。另一种常见的心脏良性肿瘤是心脏横纹肌瘤[13],10岁以下儿童多见,可随着年龄的增长而发生退化,其通常与结节性硬化症相关,超声心动图表现为生长在心室壁或房室瓣上的椭圆形中等回声团块,大部分为多发,大小不等,与周围组织分界清,活动度小,比周围正常心肌回声稍强,CT扫描可见多发结节状病灶,增强后呈现低密度。MRI的T1加权像与心肌等信号,T2加权像为高信号,延迟显像不增强。静脉内平滑肌瘤病是另一种较为常见的累及心脏的肿瘤,组织学上属于良性的平滑肌肿瘤,来源于子宫平滑肌,累及盆腔静脉并延伸到下腔静脉或通过血管内膜平滑肌增生而产生,累及右侧心腔,形态呈条索样或者团块状,为中等回声,部分可跨过三尖瓣及右心室流出道延伸至肺动脉内。平滑肌瘤通常不会浸润心肌或者心包,影像学检查可发现下腔静脉内有同性质肿块与之相连续[14]。心腔内最常见的非肿瘤性占位是血栓,主要发生于血流瘀滞的部位,通常有心房颤动、局部室壁运动异常等相关病史,主要发生在心尖部、左右心房,超声心动图显示为球形或块状,无蒂,基底较宽,活动度小,无侵犯周围组织的表现,新鲜血栓回声偏低,陈旧血栓尤其发生钙化时回声增强。MRI在血栓急性期表现为T1和T2加权显像高信号,慢性期T1和T2均为低信号,延迟显像无增强[15],这个特点可与血管肉瘤鉴别。
多模态影像学检查有利于原发心脏血管肉瘤的检出,但确诊依然需要病理,免疫组化表现为特征性的CD31、CD34和ERG阳性,最常见的细胞形态学表现为梭形细胞,但也有单纯上皮样和同时含有梭形细胞及上皮样特征的形式[10]。心包积液细胞学诊断敏感性很差,本研究有7例患者病程中反复出现血性心包积液,仅1例检出极少量异型细胞。
原发性心脏血管肉瘤在诊断时往往已经发生转移,发生率为56%~76%,肺部是最常见的转移部位[16]。原发性心脏血管肉瘤预后很差,不进行手术切除者中位生存期仅1个月。治疗方式首选手术切除,然而由于血管肉瘤生长迅速、局部侵袭性高、易远处转移及诊断的延迟,较难达到完整切除肿瘤,往往还要联合化疗和放疗。经过联合治疗后患者的中位生存期为13~28个月,肿瘤比较局限、能够完整手术切除是预后良好的预测指标[17]。提高临床医生对心脏血管肉瘤的认识,结合多种影像学检查,使得患者能够获得早期诊断和手术治疗,是改善患者预后的关键。
作者贡献:胡婷婷负责数据分析、稿件撰写及修改;郭立琳、朱园园负责稿件指导;田庄负责方案提出、稿件修改、经费支持。利益冲突:所有作者均声明不存在利益冲突。 -
表 1 原发性心脏血管肉瘤的超声心动图表现
Table 1 Echocardiographic manifestations of primary cardiac angiosarcoma
患者编号 肿瘤部位及大小(mm) 肿瘤回声及形态 肿瘤活动度 首次发现时心包积液量(外院) 本次入院时心包积液量 心脏腔室大小 其他 1 右心房;72×41 中低回声团块 不详 中量 中量 右心房增大 占位内可见血流信号,缩窄性心包炎改变 2 心包;17×9,29×18 低回声团块,不规则中等回声团块 不详 大量 中量 左心房增大 无 3 心包;40×62 不均匀回声团块 不详 引流出350 mL血性积液 微量 正常 右心房侧壁受压 4 右心房顶外心包内近右心房室沟;54×20 中等回声团块 不详 引流出700 mL积液 少量 左心房增大 占位似浸入右心房内 5 NA NA NA NA 中量 正常 无 6 右心房及心包;49×25 中低回声团块 不详 大量 无 不详 占位内血流丰富 7 右心房内、升主动脉周围;69×46 中低回声不规则团块,内见多发无回声区 低 NA 无 双房增大 占位与周边组织粘连 8 右心房内附着于右心房侧壁;29×18 中等回声、不规则分叶状团块 较大 大量 少量 正常 占位向心房外浸润生长;三尖瓣轻度梗阻 9 右心房顶及侧壁;63×35 不均匀回声团块 不详 少量 少量 正常 累及右心房室沟 10 右心房后侧壁外心包腔内;57×31 中等回声不规则团块 不详 不详 大量 正常 致右心房受压变形 11 右心房内上腔静脉周围,75×45;主动脉及肺动脉根部 中强回声、不均质团块 不详 大量 微量 双房右心室增大 无 12 右心房、右心耳内;29×47 中低回声团块 固定 大量 无 正常 与房壁关系紧密 13 右心房外心包内;69×54 中等回声团块 不详 大量 大量 正常 占位与右心房关系紧密;心包填塞 14 右心房壁增厚13;右心房室侧壁占位,最宽处26 中强回声 低,附壁 大量 微量 正常 右心室收缩功能减低 15 心包占位;58×24 中低回声及无回声、不规则占位 不详 少量 微量 正常 占位侵犯右心房,占位内低回声区血流与右心房交通;右心室收缩功能减低 16 心包腔内右心房顶部;53×35 囊实性团块 不详 少量,2 d后急诊穿刺100 mL血性心包积液 微量 正常 右心舒张受限 17 右心房侧壁;37×25 中低回声 不详 无 无 正常 占位侵犯三尖瓣瓣环;曾行肿瘤切除,此次复发 18 心包、右心房;58×52 中等回声团块 较大 大量 少量 正常 侵犯右心房侧壁向右心房生长 19 右心房,78×29;右心室流出道,47×15 中等回声团块 较大,随三尖瓣启闭移动 无 无 正常 与三尖瓣前叶关系紧密 20 心包;50×49 不均匀回声 不详 不详 少量 正常 占位向右心房内生长 21 右心房;最厚处28 中等回声,弥漫不规则改变 低,附壁 无 无 右心房增大 无 22 心包、右心房;83×56 中等回声团块 不详 大量 少量 无 心包局部粘连;占位压迫右心房侧壁,侵犯三尖瓣前叶瓣环;占位内血流丰富 23 右心房壁增厚; 6×26 中等回声 低,附壁 大量 大量 无 心包填塞 24 附着于房间隔累及左右心房;49×30 中低回声团块 固定 无 无 双房左心室增大 占位侵犯二尖瓣及三尖瓣瓣环,重度二、三尖瓣关闭不全 25 右心室;49×42 中等回声、不规则分叶状 不详 少量 少量 右心增大 占位致右心室流出道梗阻并侵犯三尖瓣,三尖瓣中-重度关闭不全;右心室收缩功能减低 NA表示不适用 表 2 原发性心脏血管肉瘤的其他影像学表现
Table 2 Other imaging features of primary cardiac angiosarcoma
患者编号 CT CMR PET/CT 肿瘤部位及密度 增强扫描 肿瘤部位及大小 信号强度及增强扫描 肿瘤位置大小及SUV值 转移部位 1 无 无 无 无 无 无 2 右侧房室间沟; 不规则混杂密度影 轻度强化,与右心房室及右冠状动脉中段分界不清,纵隔转移,胸膜转移 无 无 右侧心包内略低密度肿块SUVmax 10.4,心包横窦内及升主动脉后方均可见软组织密度灶SUVmax 12.2 肺,纵隔淋巴结 3 右心房;密度不均 无 无 无 心包内软组织密度影,形态不规则,内见坏死,6.5 cm×7.1 cm×5.9 cm放射性摄取环形增高,SUVmax 7.2 肝脏,甲状腺 4 无 无 无 无 右心房内软组织密度,2.8 cm×5.4 cm×8.3 cm,SUVmax 4.7 无 5 升主动脉右心房间;类圆形稍高密度影,平扫CT值44 HU 未见明显强化 右心房室沟、升主动脉右侧、右冠状动脉后方;6.3 cm×6.0 cm分叶状,侵犯右心房壁突向心包腔 T 1W、T 2W不均匀稍高信号 无 无 6 右心房;混杂软组织密度团块影,部分呈稍高密度 强化不明显,可见右冠状动脉小分支向病变内供血,病变与右冠状动脉中段、右心房关系密切 无 无 右心房形态不规则密度不均匀团块,SUVmax 1.9 颈部淋巴结 7 右心房前上方;低密度,与右心房边界欠清,平扫CT值38 HU 未见明显强化 无 无 无 无 8 右心房;形态欠规则分叶状,密度欠均边界不清 未见明显强化,心包局部增厚,双肺及胸膜多发结节灶伴空洞,代谢增高 无 无 右心房巨大软组织肿物,代谢增高 肺,胸膜 9 右心房;软组织团块影,边界不清 轻-中度强化,临近心包受累 无 无 右心房内不规则等密度灶并代谢增高,心包略增厚 无 10 右心房;密度不详,肿瘤为右冠状动脉分支供血 无 无 无 无 无 11 心包内升主动脉周围及肺动脉下方;密度不均匀,累及右心房右心室 无 纵隔内混杂信号影 T 1W不均匀低信号,T 2W不均匀高信号,增强扫描不均匀轻度强化,边界不清形态不规则 上纵隔10.0 cm×7.5 cm囊实性占位,包绕升主动脉,实性部分SUVmax 7.4 无 12 右心房心耳区;密度不详 不规则稍低强化灶,内见血管样强化 无 无 无 无 13 心包右侧;稍高密度 片状不均匀强化 心包内右心房外团片状占位,7.3 cm×5.4 cm,与右心房外侧壁及局部心包关系密切,右冠状动脉中段与占位分界欠清 T 1W混杂稍高信号,T 2W高信号,增强扫描不均匀片状强化,边缘强化较明显,局部心包可见强化 心包右侧,大小8.0 cm×5.0 cm×9.5 cm,SUVmax 30.2 无 14 右心房及右心耳外壁结节样不均匀增厚;软组织密度 明显强化,心包不均匀增厚伴异常强化 无 无 上腔静脉下段-右心房-右心耳3.4 cm×2.7 cm×3.6 cm代谢不均匀异常增高占位,SUVmax 18.3 双侧锁骨上区,上纵隔淋巴结 15 右心房、右侧心包;软组织密度 明显强化,病变累及右心房壁并向右心房腔内生长,双肺结节影伴强化 右心房前壁及下壁增厚可见软组织占位,向右心房腔内生长,边界较规则,最厚约20 mm 信号不均匀,T 1W低信号,T 2W高信号 心包内软组织肿块,SUVmax 14.8 双肺,纵隔淋巴结 16 心包;不规则软组织密度影 明显强化,双肺结节影,呈磨玻璃密度,内见空泡 无 无 右心房顶心包内囊实性软组织肿块,8.7 cm×4.2 cm,SUVmax 14.9 双肺 17 右心房前方;团片状软组织密度影,CT值31 HU 病灶内部斑片状不规则明显强化影,心包不规则增厚 无 无 术区、右心房内、右心耳旁、纵隔血管间隙不规则团块状及结节状高代谢灶SUVmax 8.7 无 18 右心房室交界处;混杂密度影,供血动脉为右冠状动脉小分支,病变包绕右冠状动脉中远段,心包不均匀结节状增厚 不详 无 无 右心内软组织肿块伴代谢增高 心包、主动脉弓旁、双肺下叶、右锁骨上多发转移淋巴结 19 无 无 无 无 无 无 20 右心房壁外心包内;软组织密度 明显强化,右冠状动脉分支供血,病变与上腔静脉及右冠状动脉局部分界不清 无 无 纵隔右侧不规则软组织肿块代谢异常增高 心包膜及胸部多发淋巴结转移 21 无 无 右心房侧壁不规则增厚并局部形成厚层占位突入右心房腔内,无明显活动度,与右心房壁分界不清,外缘光滑内缘不规则 内部为均匀等信号 无 无 22 无 无 无 无 心包软组织病变,3.3 cm×2.1 cm,SUVmax 7.3 无 23 上腔静脉下段、右心房内;等密度占位 混杂低强化,边界不清,与右心房后壁分界不清 上腔静脉下段及右心房壁近右心耳处 条片状等T 1、等T 2信号,增强扫描部分可见早期强化,心包增厚伴强化 上腔静脉至右心房局部密度增高灶,12 mm×24 mm×29 mm,SUVmax 10.5,延迟显像SUVmax 13.0 双肺,腋窝淋巴结 24 左心房下部不规则团片状低密度影,中心伴钙化影 中度强化,累及房间隔及右心房 无 无 无 无 25 右心室;不规则低密度影 无 无 无 右心室囊实性占位,4.4 cm×3.3 cm,4.3 cm×3.5 cm,SUVmax 22.6,心包积液SUVmax 1.5 无 CMR: 心脏核磁共振; PET/CT: 正电子发射计算机断层显像; SUVmax: 最大标准摄取值; T 1W: T 1加权像; T 2W: T 2加权像; NA表示不适用 表 3 心脏血管肉瘤的免疫组织化学结果
Table 3 Immunohistochemistry result of cardiac angiosarcoma
患者编号 性别 年龄(岁) 特征性病理免疫组化标志物 CD34 CD31 ERG Fli-1 SMA F8-R 1 男 25 + + + + + + 2 男 47 + + + + + + 3 女 47 + + + + + + 4 女 50 + + + + + + 5 男 43 + + + + + + 6 女 14 + + + + + + 7 女 61 + + + + + + 8 男 33 + + + + + + 9 女 33 + + + + + + 10 女 37 + + + + + + 11 男 57 + + + + + + 12 男 20 + + + + + + 13 女 51 + + + + + + 14 女 50 + + + + + + 15 女 32 + + + + + + 16 男 32 + + + + + + 17 女 24 + + + + + + 18 男 25 + + + + + + 19 男 74 + + + + + + 20 女 20 + + + + + + 21 男 70 + + + + + + 22 男 61 + + + + + + 23 女 55 + + + + + + 24 男 55 + + + + + + 25 女 53 + + + + + + -
[1] Randhawa JS, Budd GT, Randhawa M, et al. Primary cardiac sarcoma: 25-year cleveland clinic experience[J]. Am J Clin Oncol, 2016, 39(6): 593-599. doi: 10.1097/COC.0000000000000106
[2] Florou V, Wilky BA. Current management of angiosarcoma: recent advances and lessons from the past[J]. Curr Treat Options Oncol, 2021, 22(7): 61. doi: 10.1007/s11864-021-00858-9
[3] Butany J, Yu W. Cardiac angiosarcoma: two cases and a review of the literature[J]. Can J Cardiol, 2000, 16(2): 197-205.
[4] Riles E, Gupta S, Wang DD, et al. Primary cardiac angiosarcoma: a diagnostic challenge in a young man with recurrent pericardial effusions[J]. Exp Clin Cardiol, 2012, 17(1): 39-42.
[5] Tang QY, Guo LD, Wang WX, et al. Usefulness of contrast perfusion echocardiography for differential diagnosis of cardiac masses[J]. Ultrasound Med Biol, 2015, 41(9): 2382-2390. doi: 10.1016/j.ultrasmedbio.2015.05.010
[6] Chen Y, Li Y, Zhang N, et al. Clinical and imaging features of primary cardiac angiosarcoma[J]. Diagnostics (Basel), 2020, 10(10): 776. doi: 10.3390/diagnostics10100776
[7] Li X, Lan L, Hu H. Case report: primary cardiac angiosarcoma with multiple metastases[J]. Front Cardiovasc Med, 2022, 9: 941967. doi: 10.3389/fcvm.2022.941967
[8] Yu JF, Cui H, Ji GM, et al. Clinical and imaging manifestations of primary cardiac angiosarcoma[J]. BMC Med Imaging, 2019, 19(1): 16. doi: 10.1186/s12880-019-0318-4
[9] Araoz PA, Eklund HE, Welch TJ, et al. CT and MR imaging of primary cardiac malignancies[J]. Radiographics, 1999, 19(6): 1421-1434. doi: 10.1148/radiographics.19.6.g99no031421
[10] Göbölös L, Bhatnagar G. Angiosarcoma of the heart[J]. JACC Case Rep, 2021, 3(6): 950-953. doi: 10.1016/j.jaccas.2021.04.030
[11] Yin H, Mao W, Tan H, et al. Role of (18)F-FDG PET/CT imaging in cardiac and pericardial masses[J]. J Nucl Cardiol, 2022, 29(3): 1293-1303. doi: 10.1007/s12350-020-02510-9
[12] Yaddanapudi K, Brunken R, Tan CD, et al. PET-MR imaging in evaluation of cardiac and paracardiac masses with histopathologic correlation[J]. JACC Cardiovasc Imaging, 2016, 9(1): 82-85. doi: 10.1016/j.jcmg.2015.04.028
[13] Bruce CJ. Cardiac tumours: diagnosis and management[J]. Heart, 2011, 97(2): 151-160. doi: 10.1136/hrt.2009.186320
[14] Masood I, Duran C, Malik K, et al. Uterineintravenous leiomyomatosis with cardiac involvement[J]. Radiol Case Rep, 2020, 15(8): 1389-1393. doi: 10.1016/j.radcr.2020.05.053
[15] Li X, Chen Y, Liu J, et al. Cardiac magnetic resonance imaging of primary cardiac tumors[J]. Quant Imaging Med Surg, 2020, 10(1): 294-313. doi: 10.21037/qims.2019.11.13
[16] Kupsky DF, Newman DB, Kumar G, et al. Echocardiographic features of cardiac angiosarcomas: the mayo clinic experience (1976-2013)[J]. Echocardiography, 2016, 33(2): 186-192. doi: 10.1111/echo.13060
[17] Hammami MB, Al-Wawi MZ, Fazel H, et al. Incidence, prognostic significance, and survival outcomes of primary cardiac sarcoma: an updated population-based retrospective study[J]. Anatol J Cardiol, 2021, 25(2): 104-110.
-
期刊类型引用(2)
1. 胡婷婷,郭立琳,田庄,朱燕林. 右心房血管肉瘤1例. 中华全科医师杂志. 2024(01): 70-72 .  百度学术
百度学术
2. 李娜,杨松梅,熊燕,何俊安,张洪. 中西医结合治疗原发性心脏血管肉瘤伴肺转移临床报道. 中医临床研究. 2024(24): 57-61 .  百度学术
百度学术
其他类型引用(0)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 主编办公
主编办公

 下载:
下载: