Chronic Thromboembolic Pulmonary Hypertension and ChronicThromboembolic Pulmonary Disease
-
摘要:
慢性血栓栓塞性肺动脉高压(CTEPH)和慢性血栓栓塞性肺疾病(CTEPD)是急性肺栓塞后因肺动脉内血栓残留、机化,伴或不伴肺动脉高压(PH)的一类疾病。随着诊疗的不断进步、综合治疗策略的观念更新,使这类疾病的预后得到极大改善。但医务人员对这类疾病认识不足,且中国缺少流行病学数据,发病机制未明,具有非特异性临床表现。因此,在临床上易误诊、漏诊和延迟诊断。为了加强医务工作者对其认识,本文对CTEPH和CTEPD的定义、流行病学、病理、发病机制、诊断和治疗等方面予以归纳总结。
-
关键词:
- 慢性血栓栓塞性肺动脉高压 /
- 慢性血栓栓塞性肺疾病 /
- 肺血栓栓塞症
Abstract:Chronic thromboembolic pulmonary hypertension (CTEPH) and chronic thromboembolic pulmonary disease (CTEPD) are diseases that occur after acute pulmonary embolism resulting from residual and organized intra-pulmonary thrombus, with or without pulmonary hypertension(PH). The prognosis of these diseases has been dramatically improved with the continuous progress of treatment and the updated concept of the comprehensive treatment strategy. However, there is a lack of awareness of these diseases among medical practitioners, and a lack of epidemiological data in China, with unknown pathogenesis and non-specific clinical manifestations. Therefore, it is easy to misdiagnosis, underdiagnosis and delay diagnosis in clinical practice. To enhance the understanding of medical personnel, this paper summarizes the definition, epidemiology, pathology, pathogenesis, diagnosis and treatment of CTEPH and CTEPD.
-
急性肺血栓栓塞症(pulmonary thromboembolism,PTE) 是一种常见的危及生命的急性心肺血管疾病。经规范抗凝治疗后,肺动脉内大部分血栓可以溶解,Nijkeuter等[1]的荟萃分析表明,在PTE抗凝治疗后8 d、6周、3个月、6个月和11个月的肺血栓残留比例分别为87%、68%、65%、57%和52%,提示在急性PTE后持续性肺血栓残留很常见。在急性PTE患者的随访过程中发现近50%的患者存在不能用其他疾病解释的持续性呼吸困难、活动受限、机体功能状态及生活质量下降,称为PTE后综合征,其可能的机制是由未溶解的肺动脉血栓机化影响肺动脉血流动力学、右心室损伤和气体交换所致[2-3],是急性PTE的长期并发症[4-5]。而《2020ERS慢性血栓栓塞性肺高压声明》[6]和《2022ESC/ERS肺动脉高压诊断和治疗指南》[7]将PTE规范抗凝3个月以上,存在劳力性呼吸困难症状,并可归因于肺动脉血栓残留的这类疾病,称为慢性血栓栓塞性肺疾病(chronic thrombo-embolic pulmonary disease,CTEPD),CTEPD可以伴或不伴有肺动脉高压(pulmonary hypertension,PH),其中将伴有PH的患者称为慢性血栓栓塞性肺动脉高压(chronic thromboembolic pul-monary hypertension,CTEPH)。而中国指南所指的CTEPD是指不伴有PH的患者。CTEPH和CTEPD被认为是急性PTE的一种远期并发症。随着外科手术和介入治疗手段的不断进步、CTEPH靶向药物的开发,以及多种治疗手段综合治疗策略的观念更新,患者的预后已得到显著改善。而中国医务人员对CTEPH和CTEPD的诊治意识相对不足,且疾病本身存在一定的隐匿性,临床容易漏诊、误诊。为了加强医务工作者对CTEPH和CTEPD的认识,本文对其定义、流行病学特点、病理、发病机制、临床表现、诊断和治疗等方面的研究进展予以归纳总结。
1. 定义
1.1 CTEPH的定义
CTEPH是以肺动脉血栓机化、肺血管重构致血管狭窄或闭塞,肺动脉压力进行性升高,最终导致右心功能衰竭为特征的一类疾病。CTEPH属于PH的第四大类,也是目前唯一可能治愈的PH。CTEPH的诊断标准:经过3个月以上规范抗凝治疗后,影像学证实肺动脉存在慢性血栓,静息状态下右心导管检查(right heart catheterization,RHC)测得平均肺动脉压(mean pulmonary arterial pressure,mPAP)≥25 mm Hg,且除外其他病变,如血管炎、肺动脉肉瘤等。经肺动脉CT血管造影、MRI等影像学的CTEPH特定的诊断征象(如肺动脉内偏心性附壁充盈缺损、肺动脉闭塞、血管腔内线状或网状纤维化等)[8]。2018年第6届肺动脉高压诊断与分级工作组提出将PH阈值设置为mPAP>20 mm Hg,但未达成共识[9]。而《2022ESC/ERS肺动脉高压诊断和治疗指南》[7]对于毛细血管前性PH采用了这一阈值。对于mPAP在21~24 mm Hg这类患者的研究数据目前十分有限,可能会成为未来几年研究的热点。目前中国的PH定义仍是mPAP≥25 mm Hg。
1.2 CTEPD的定义
CTEPD具有与CTEPH相似的症状和肺动脉内充盈缺损,但静息状态不存在PH。据国际血栓与止血学会指南,CTEPD的标准如下:①纽约心脏协会(New York Heart Association,NYHA)Ⅱ、Ⅲ或Ⅳ级的劳力性呼吸困难;②经过3个月的充分抗凝治疗,肺动脉内仍存在血栓样物质所致的充盈缺损;③休息时,RHC检查mPAP<25 mm Hg;④心肺运动试验(cardiopulmonary exercise testing,CPET)提示死腔样通气增加或存在运动性PH[10]。在评估CTEPD患者病情时,CPET和经胸超声心动图都有助于排除劳力性呼吸困难的其他原因。CTEPD的持续症状与死腔通气增加、运动相关PH、右心室适应不良导致右心室顺应性降低等因素有关[5, 11-14]。van Kan等[11]的研究表明,CTEPD患者休息时mPAP正常,而运动后RHC检查符合运动性PH表现,CTEPD可能是CTEPH的潜在早期阶段。
2. 流行病学
2.1 CTEPH的流行病学
CTEPH为罕见病,由于诊断不足,CTEPH在普通人群的真实发病率和患病率无法精确计算。根据Leber等[15]的系统研究估算,CTEPH的患病率波动于14.5~144/100万,且不同国家和地区的患病率不尽相同,而目前中国尚无CTEPH患病率的确切数据。
CTEPH通常被认为是急性PTE的远期并发症[3]。在一项纳入679例CTEPH患者的大型国际注册登记研究中,74.8%的患者有急性PTE病史,56.1%的患者有深静脉血栓病史,且CTEPH患者从出现症状到确诊的平均时间为14.1个月[16],提示CTEPH存在诊断延迟的问题。Lang等[17]研究也发现,40%~60%的CTEPH缺乏急性PTE病史,虽然仍有患者缺少静脉血栓栓塞症(venous thromboembolism,VTE)的证据,但急性PTE仍是发生CTEPH的重要危险因素。症状性急性PTE后CTEPH的发生率为0.1% ~11.8%[7]。Yu等[18]的一项急性PTE后CTEPH的真实世界研究发现急性PTE后3个月、1年、2年、3年经RHC确诊的CTEPH的发病率分别为1.2%、12.7%、13.4%、14.5%。由于CTEPH的诊断相对复杂,以及各个研究筛查CTEPH方法的不同,导致不同研究间CTEPH发病率结果存在差异。
2.2 CTEPD的流行病学
CTEPD是近几年提出的概念,有关研究较少。目前尚无CTEPD的流行病学资料。一项回顾性研究表明[19],在845例PTE患者中,经过PTE规范抗凝治疗6个月及以上时发现450例患者仍存在活动耐量下降,其中38例诊断为CTEPH,15例诊断为CTEPD,在有症状的患者中发生率分别为8.4%、3.3%,CTEPH和CTEPD的发病率分别为4.5%、1.8%。根据2022ESC/ERS指南,CTEPD的诊断应在抗凝治疗3个月后即开始评估,而此研究是在抗凝6个月后进行评估,可能会低估CTEPD的实际发病率。CTEPD的流行病学数据仍需大样本的前瞻性注册登记研究来阐明。
3. 病理和发病机制
3.1 病理特点
在解剖学上,有两种血管病变参与CTEPD和CTEPH患者肺血管阻力(pulmonary vascular resistance,PVR) 的增加,即未溶解的血栓机化形成纤维样物质的阻塞和继发性微血管病变。阻塞的部位主要发生在段或亚段肺动脉,肺动脉内阻塞物可延伸至腺泡内层的肺动脉。近端阻塞的病变可在影像学上表现为裂缝、网、狭窄或囊袋样改变,而远端阻塞性病变可部分再通或多发漏斗样病变。继发性微血管病变类似动脉型肺动脉高压(pulmonary arterial hyperten-sion,PAH)的微血管病变,主要累及肌性肺动脉(直径50~500 μm)。微血管病变的特征在于毛细血管前动脉、毛细血管和肺小静脉(肺静脉闭塞样)的水平重塑。静脉微血管的重塑现象在人和动物模型中也有发现[6]。肺动脉阻塞和微血管病变,使PVR增加,肺动脉压力进行性增高,最终导致右心后负荷加重,发生右心衰竭。
CTEPD可能存在与CTEPH类似的肺血管病理改变,即经规范抗凝3个月后,肺动脉内仍存在血栓阻塞及机化。CTEPD可能血栓阻塞或机化的范围较小,且微血管病变一般不存在或者范围较小,因而不伴有肺动脉压力的升高[6]。目前CTEPD的诊断和疾病模型的构建仍是目前的难点,需加大有关CTEPD发病机制的研究。
3.2 发病机制
CTEPD和CTEPH的具体发病机制目前仍未阐明。但目前明确的CTEPH的发病危险因素主要有甲状腺功能减退症、恶性肿瘤、复发性VTE、大面积肺栓塞、抗磷脂抗体阳性、凝血因子Ⅷ升高、非O型血、心室心房分流术或起搏器、脾切除术后。此外,狼疮抗凝物血管假性血友病因子水平升高、某些纤维蛋白原异常(如纤维蛋白原Aa链Ala312等位基因)、肺血管内皮损伤等均会增加CTEPH风险[6]。
4. 临床表现与诊断策略
4.1 临床表现
CTEPH的早期症状和体征是非特异性的,甚至无症状。一项国际多中心的注册登记研究发现,CTEPH最常见的症状是呼吸困难(99%),其次是水肿(41%)、疲劳(32%)、胸痛(15%)和晕厥(14%)[16]。CTEPH患者的体格检查早期多为阴性,晚期可以出现PH、右心衰竭的表现,包括肺动脉听诊区第二心音亢进、三尖瓣反流性杂音、肺动脉瓣杂音、颈静脉搏动增强、肝颈静脉反流和外周水肿等。一些患者存在所谓的“蜜月期”,即PTE患者在规范治疗几个月甚至几年后才出现临床上显著的症状。在此期间,肺动脉血栓或持续存在,并可能已经出现肺血管重塑。由于存在所谓的“蜜月期”,加之医护人员对CTEPD和CTEPH的认识不足,导致诊断的延迟或误诊。一项国际多中心登记研究表明,CTEPH患者从症状出现到确诊的中位时间为14个月,且81.4%的CTEPH患者在确诊时心功能处于NYHA Ⅲ级或Ⅳ级[16]。延迟诊断>24.5个月的患者与<24.5个月的CTEPH患者相比,其全因死亡率提高47%,提示延迟诊断CTEPH会增加患者的病死率[20]。因此,如何早期发现早期诊断CTEPD和CTEPH是临床工作中的重点、难点。
4.2 诊断策略
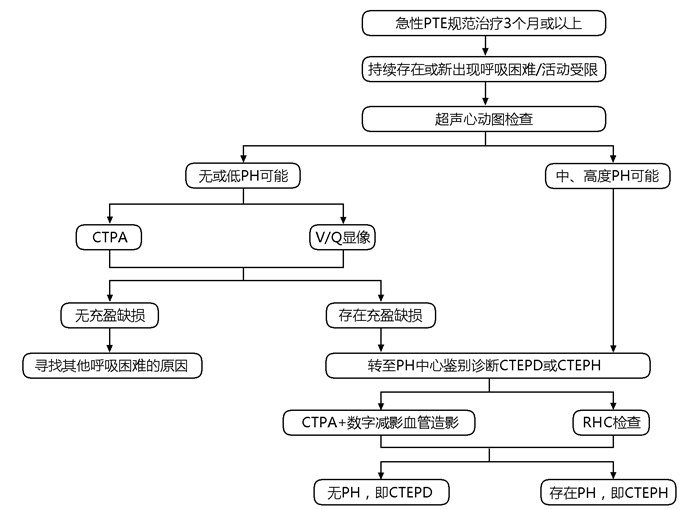
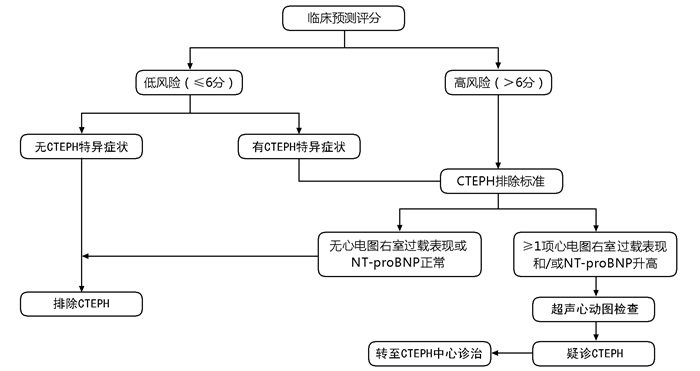
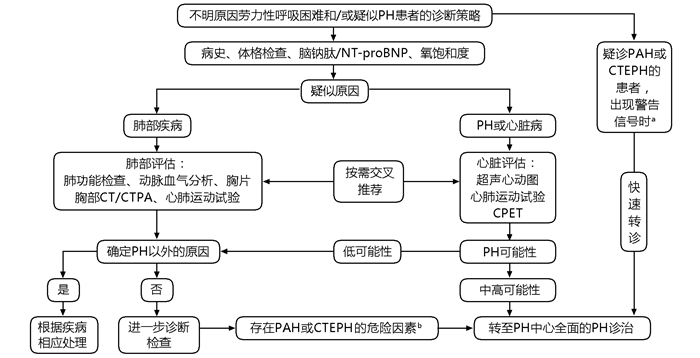
CTEPD和CTEPH的早期症状和体征多为非特异性,而部分患者不存在PTE病史,临床上常难以早期诊断CTEPD或CTEPH。诊断策略分为两种情况:一是对于无明确VTE病史、疑诊PH患者,可以参照2022ESC/ERS指南的疑诊-检查-确诊的诊断流程[7](图 1),即对于原因不明的呼吸困难的患者,首先需要细致的病史、体格检查、心电图、超声心动图检查,若发现中高度可能性的PH患者,需要转至PH中心进一步明确诊断。另一种情况是PTE后CTEPD和CTEPH的诊断策略(图 2),有PTE或VTE病史的患者,出现持续性呼吸困难或新出现的呼吸困难,尤其是伴有CTEPH危险因素的患者,根据指南首先考虑行超声心动图筛查,对于中高度PH可能的患者,需完善影像学检查,若存在肺动脉充盈缺损,则应该考虑CTEPH可能,建议转诊至有CTEPH诊治经验的中心进一步行RHC等检查明确诊断。对于超声心动图无或低度PH可能的患者,应该考虑核素肺灌注显像(V/Q)和/或CT肺动脉造影(CT pulmonary angiography,CTPA),甚至CPET、肺功能等检查,若存在充盈缺陷或肺动脉阻塞的征象,要考虑CTEPD的可能,进一步完善功能超声心动图、CPET检查,或转诊至PH中心,进行RHC检查。若无PH,或存在运动性PH则考虑CTEPD。另外,PTE后约有4%的患者会发展为CTEPH,因此CTEPH的排除诊断策略也十分重要,如Leiden CTEPH排除标准[21]在临床上也有一定的应用(图 3)。
5. 治疗
5.1 CTEPH的治疗
CTEPH治疗策略包括针对PAH的一般治疗同样也适用于CTEPH,如氧疗、利尿剂、抗凝、运动训练、疫苗接种及心理社会支持等[7]。其特异性的治疗主要是根据解剖病变部位的不同(近端、远端和微血管病变),肺动脉内膜切除术(pulmonary endarterectomy,PEA)、肺动脉球囊扩张术(balloon pulmonaryangio- plasty,BPA)和靶向药物治疗的不同组合多模式治疗方法。本文主要讨论抗凝治疗、PEA、BPA和药物治疗4个方面。
5.1.1 抗凝治疗
复发性PTE并伴有血栓溶解不全是CTEPH的主要病理生理特征,因而国内外指南均建议进行终身抗凝治疗。虽然无任何经随机对照试验(randomized controlled trial,RCT)验证用于CTEPH的抗凝治疗的合适药物,但专家们更倾向于推荐维生素K拮抗剂(vitamin K antagonists,VKAs)华法林,且对于存在抗磷脂综合征的CTEPH患者(约占CTEPH人群的10%),指南也推荐使用VKAs[6]。随着新型口服抗凝药(new oral anticoagulants,NOACs)的广泛应用及便利性,NOACs也经常应用于CTEPH的抗凝治疗,但NOACs在CTEPH的应用同样缺乏RCT试验证据。有学者对PEA术后的组织标本进行研究,结果发现在接受NOACs抗凝治疗的CTEPH患者存在急性或亚急性血栓的比例高于VKAs组[22],这个证据让研究者们对NOACs在CTEPH抗凝治疗中的安全性和有效性的问题产生了质疑。而近期一项随机对照试验纳入96例PEA术后的患者,随机分别给予利伐沙班及华法林抗凝治疗,在随访3个月、6个月的血栓复发的风险方面两组之间无差异,但缺少更长时间的随访结果[23]。目前仍缺乏大样本多中心的RCT研究来评估NOACs和VKAs对CTEPH的治疗安全性及有效性。
5.1.2 PEA
PEA是可手术治疗CTEPH患者的首选治疗方法,PEA可将肺动脉内的血栓及机化内膜切除,改善肺通气/血流,改善右心功能障碍,防止微血管病变进一步恶化,肺血流动力学和功能正常化或接近正常化(PVR降低约65%)[7]。CTEPH是唯一可通过PEA达到治愈效果的PH类型,指南推荐对所有确诊为CTEPH的患者首先进行PEA的可行性评估。评估是一个复杂的过程,需综合考虑多种因素,包括团队经验、肺动脉病变的可及性、PH严重程度与肺动脉阻塞程度之间的相关性及合并症等[7]。PEA的适应证为术前WHO心功能Ⅱ~Ⅵ级、外科手术可及的肺动脉主干、肺叶或肺动脉段血栓[24]。PEA可显著改善CTEPH患者的远期预后,研究表明可手术的CTEPH患者接受PEA与未进行PEA治疗的患者相比,其5年病死率分别为83%和53%[25]。而随着PH中心经验的积累、对CTEPH病理生理学研究的加深及PEA技术发展,一些中心对于段级远端的CTEPH患者也尝试进行PEA治疗,使得CTEPH的手术受益人群进一步扩大,并取得了较好疗效[26-28]。而PEA的风险和收益并存,常见的手术并发症有再灌注肺水肿、术后持续性PH、深低温下神经系统并发症和凝血功能障碍等。因此,必须由经验丰富的PEA外科医生组成的多学科专家团队来评估手术的可能性并决定最终治疗方案。
5.1.3 BPA
虽然PEA可改善CTEPH患者的预后,但仍有约40%的CTEPH患者无法进行PEA治疗[16],PEA术后的患者仍有25%存在PH[29],这些不能手术及手术后残留PH的患者仍需要积极采用其他治疗方法(如BPA和药物治疗)。BPA是利用机械性方法破坏肺动脉内机化的组织,扩张狭窄肺动脉,增加肺血流量。BPA已成为不能手术或PEA后持续/复发性PH患者的重要选择,也可以作为危重患者的救治措施[30],以及作为PEA治疗失败后的补救治疗的选择[31]。一项国际多中心研究表明,BPA可以在短期内改善CTEPH的血流动力学、肺灌注、运动耐量和生活质量[32]。同时BPA也可以改善CTEPH患者的长期预后,如日本的一项CTEPH中心研究发现,BPA术后患者mPAP、PVR的改善持续了3.5年,其1年、2年和3年的总存活率分别为99%、98%和96%[33]。而另外一项多中心注册登记研究也得到类似的结果[34]。而中国CTEPH的回顾性研究也结果表明BPA术后1年、3年、5年和7年的总生存率分别为98.4%、97.4%、95.3%和89.3%,但略低于PEA术后的结果[35]。
BPA较PEA创伤小,可操作性高,但有再灌注性肺水肿、咯血、肺损伤、肺动脉穿孔、肾损伤、心包积液等风险及并发症。因此,为了减少BPA的并发症,BPA常以分阶段、逐步的方式进行。而Tani-guchi等[36]对24例符合PEA条件和29例不能手术的而选择BPA的患者进行回顾性分析,发现BPA组和PEA组患者降低mPAP、PVR方面及心输出量改善程度方面疗效相当。尽管这些研究证明了BPA具有良好疗效,但开展BPA需要一定的经验和技术,BPA应在有经验的CTEPH中心进行。
5.1.4 靶向药物治疗
CTEPH患者存在微血管病变,其组织学表现类似于第一大类PH,这为靶向药物治疗CTEPH提供了理论基础。目前用于治疗PAH治疗的靶向药物包括内皮素受体拮抗剂、磷酸二酯酶抑制剂、前列环素类药物、前列环素受体激动剂、一氧化氮(NO)信号通路相关的药物,目前的证据表明上述药物均可在一定程度上改善CTEPH的症状和血流动力学指标,而目前仅有利奥西呱[37-38]和曲前列环素[39]批准用于CTEPH的治疗。其他的靶向药物,如西地那非、波生坦、安贝生坦、马昔腾坦和司来帕格等这些药物RCT结果的整体疗效欠佳[40-42],尚未批准用于CTEPH的治疗。而75 mg马昔腾坦治疗CTEPH的RCT研究(NCT04271475),及司来帕格治疗CTEPH的SELECT研究(NCT03689244)数据尚未公布,可能为CTEPH的药物选择提供更多的临床证据。
需要注意的是,单纯的靶向药物治疗达不到PEA和BPA的治疗效果。最近BPA与利奥西呱的RCT研究也证实了这一点[43]。虽然多种靶向药物的联合应用是治疗严重血流动力学紊乱的CTEPH常用做法[44],但缺少大样本多中心RCT循证医学证据的支持。同样,也缺少关于PEA或BPA前给予靶向药物治疗能否改善CTEPH患者的手术致残率和病死率的RCT研究。
5.1.5 多学科综合治疗
CTEPH患者因自然病程不同,往往具有广泛的表型异质性。它们可能具有近端、节段性闭塞、狭窄和蛛网状病变等不同程度的混合病变。因此,目前的治疗策略应包括PEA手术、药物治疗和介入治疗在内的多模式治疗。对术前PVR较高的患者通常应用靶向药物治疗改善术前肺血流动力学[44],但仍存在争议,因为有学者认为这会延迟CTEPH患者转诊和及时PEA手术,最终导致有效治疗的延迟而影响预后[45]。部分PEA术后的患者可能有持续性或复发性的PH,这些患者也可采用药物治疗和/或介入治疗。通常推荐PEA术后mPAP≥30 mm Hg是启动靶向药物治疗的指征[46]。需要强调的是,CTEPH的诊治需要具有CTEPH治疗经验的中心及多学科专家团队共同讨论决定更适合患者的治疗方式,包括是否采取多种模式的联合治疗方式。
5.2 CTEPD的治疗
CTEPD患者主要见于PTE后残留血栓机化阻塞肺动脉所致。主要的治疗策略主要包括两个方面:终身抗凝治疗和是否进行PEA或BPA治疗。
抗凝治疗对清除已经机化的血栓组织无效,但长期抗凝对于避免复发性PTE和原位血栓形成是必不可少的。CTEPD抗凝治疗面临的一个重要问题是抗凝药物该如何选择,但是目前尚无有关不同抗凝治疗药物对CTEPD患者的VTE复发及预后的研究。一项RCT研究发现,NOACs与VKAs治疗PTE患者的早期复发性VTE的风险无差异,这一强有力的证据提示抗凝药物的选择可能不影响CTEPH或CTEPD的风险[6]。然而也有证据表明,NOACs与VKAs抗凝治疗急性PTE相比,NOACs发生复发性血栓事件要高于VKAs,而复发性PTE是CTEPH的独立危险因素[6]。因此,仍需更多的证据验证哪种抗凝药物更适合PTE及CTEPD的长期抗凝治疗。
急性PTE后出现血栓残留、机化及肺动脉阻塞引起CTEPD、CTEPH。虽然目前证据不足,但多数学者认为CTEPD是CTEPH的早期阶段。最近的一项影像学研究发现,在影像学上CTEPD和CTEPH的一项区别是前者不存在微血管病变(也有可能存在影像技术不能识别的轻度微血管病变)[47]。因而,在过去的几年中,越来越多的患者在PH中心接受PEA治疗以改善症状。一项剑桥研究小组的回顾性研究报告在有症状的CTEPD患者中行PEA的结果,发现CTEPD患者PEA术后6分钟步行试验、PVR和生活质量显著改善,手术病死率远低于CTEPH患者,术后1年生存率为95%[12]。而BPA治疗CTEPD的研究表明,BPA也可改善患者的6分钟步行试验、PVR、肺动脉顺应性和N端脑钠肽前体(N-terminal pro-B natriuretic peptide,NT-proBNP)等[48-49]。虽然目前证据有限,但2022ESC/ERS指南对于PEA和BPA治疗CTEPD进行Ⅱa级别的推荐。
6. 展望
近年来,随着CTEPD和CTEPH定义的更新和人们对其认识深入,PEA、BPA和靶向药物治疗的应用,CTEPD和CTEPH的预后已得到极大的改善,CTEPH成为目前唯一一类可能治愈的PH,但CTEPD和CTEPH的具体发病机制尚不清楚,完全治愈CTEPD和CTEPH仍有很长的路要走,如何预防PTE进展为CTEPD和CTEPH仍是未来研究的重点。而微血管病变的干预是完全治愈这类疾病的重点、难点,随着基因组、代谢组、蛋白组学、单细胞测序及空间转录组等技术的应用,可能为微血管病变的治疗提供新的靶点,CTEPH的完全治愈就在不远的将来!
作者贡献:黄伸伸、邱家勇负责综述文献检索、分析和论文撰写;毛毅敏负责论文选题、分析、润色和修改。利益冲突:所有作者均声明不存在利益冲突。 -
-
[1] Nijkeuter M, Hovens MM, Davidson BL, et al. Resolution of thromboemboli in patients with acute pulmonary embolism: a systematic review[J]. Chest, 2006, 129(1): 192-197. doi: 10.1378/chest.129.1.192
[2] Tavoly M, Wik HS, Sirnes PA, et al. The impact of post-pulmonary embolism syndrome and its possible determinants[J]. Thromb Res, 2018, 171: 84-91. doi: 10.1016/j.thromres.2018.09.048
[3] Sista AK, Klok FA. Late outcomes of pulmonary embolism: the post-PE syndrome[J]. Thromb Res, 2018, 164: 157-162. doi: 10.1016/j.thromres.2017.06.017
[4] Klok FA, van der Hulle T, den Exter PL, et al. The post-PE syndrome: a new concept for chronic complications of pulmonary embolism[J]. Blood Rev, 2014, 28(6): 221-226. doi: 10.1016/j.blre.2014.07.003
[5] Klok FA, Tijmensen JE, Haeck ML, et al. Persistent dyspnea complaints at long-term follow-up after an episode of acute pulmonary embolism: results of a questionnaire[J]. Eur J Intern Med, 2008, 19(8): 625-629. doi: 10.1016/j.ejim.2008.02.006
[6] Delcroix M, Torbicki A, Gopalan D, et al. ERS statement on chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2021, 57(6): 2002828. doi: 10.1183/13993003.02828-2020
[7] Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Eur Heart J, 2022, 43(38): 3618-3731. doi: 10.1093/eurheartj/ehac237
[8] 中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组, 等. 中国肺动脉高压诊断与治疗指南(2021版)[J]. 中华医学杂志, 2021, 101(1): 11-51. doi: 10.3760/cma.j.cn112137-20201008-02778 [9] Simonneau G, Montani D, Celermajer DS, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension[J]. Eur Respir J, 2019, 53(1): 1801913. doi: 10.1183/13993003.01913-2018
[10] Le Gal G, Carrier M, Castellucci LA, et al. Development and implementation of common data elements for venous thromboembolism research: on behalf of SSC Subcommittee on official communication from the SSC of the ISTH[J]. J Thromb Haemost, 2021, 19(1): 297-303. doi: 10.1111/jth.15138
[11] van Kan C, van der Plas MN, Reesink HJ, et al. Hemodynamic and ventilatory responses during exercise in chronic thromboembolic disease[J]. J Thorac Cardiovasc Surg, 2016, 152(3): 763-771. doi: 10.1016/j.jtcvs.2016.05.058
[12] Taboad AD, Pepke-Zaba J, Jenkins DP, et al. Outcome of pulmonary endarterectomy in symptomatic chronic thromboembolic disease[J]. Eur Respir J, 2014, 44(6): 1635-1645. doi: 10.1183/09031936.00050114
[13] Mccabe C, Preston SD, Gopalan D, et al. Cardiopulmonary exercise testing suggests a beneficial response to pulmonary endarterectomy in a patient with chronic thromboembolic obstruction and normal preoperative pulmonary hemodynamics[J]. Pulm Circ, 2014, 4(1): 137-141. doi: 10.1086/674878
[14] Held M, Kolb P, Grun M, et al. Functional characterization of patients with chronic thromboembolic disease[J]. Respiration, 2016, 91(6): 503-509. doi: 10.1159/000447247
[15] Leber L, Beaudet A, Muller A. Epidemiology of pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension: identification of the most accurate estimates from a systematic literature review[J]. Pulm Circ, 2021, 11(1): 2045894020977300.
[16] Pepke-Zaba J, Delcroix M, Lang I, et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry[J]. Circulation, 2011, 124(18): 1973-1981. doi: 10.1161/CIRCULATIONAHA.110.015008
[17] Lang IM, Madani M. Update on chronic thromboembolic pulmonary hypertension[J]. Circulation, 2014, 130(6): 508-518. doi: 10.1161/CIRCULATIONAHA.114.009309
[18] Yu Y, Yang L, Zhang Y, et al. Incidence and risk factors of chronic thromboembolic pulmonary hypertension in patients with diagnosis of pulmonary embolism for the first time in real world[J]. Clin Respir J, 2018, 12(11): 2551-2558. doi: 10.1111/crj.12955
[19] Dzikowska-diduch O, Kostrubiec M, KurnickA K, et al. The post-pulmonary syndrome-results of echocardiographic driven follow up after acute pulmonary embolism[J]. Thromb Res, 2020, 186: 30-35. doi: 10.1016/j.thromres.2019.12.008
[20] Klok FA, Barco S, Konstantinides SV, et al. Determinants of diagnostic delay in chronic thromboembolic pulmonary hypertension: results from the European CTEPH Registry[J]. Eur Respir J, 2018, 52(6): 1801687. doi: 10.1183/13993003.01687-2018
[21] Boon G, Ende-verhaar YM, Bavalia R, et al. Non-invasive early exclusion of chronic thromboembolic pulmonary hypertension after acute pulmonary embolism: the InShape Ⅱ study[J]. Thorax, 2021, 76(10): 1002-1009. doi: 10.1136/thoraxjnl-2020-216324
[22] Jeong I, Fernandes T, Alotaibi M, et al. Direct oral anticoagulant use and thrombus detection in patients with chronic thromboembolic pulmonary hypertension referred for pul-monary thromboendarterectomy[J]. 2019, 54(suppl 63): OA5161.
[23] Barati S, Amini H, Ahmadi ZH, et al. Evaluating the efficacy and safety of rivaroxaban as a warfarin alternative in chronic thromboembolic pulmonary hypertension patients undergoing pulmonary endarterectomy: a randomized clinical trial[J]. Rev Port Cardiol, 2022, S0870-2551(22)00458-9.
[24] Galie N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT)[J]. Eur Heart J, 2016, 37(1): 67-119. doi: 10.1093/eurheartj/ehv317
[25] Quadery SR, Swift AJ, Billings CG, et al. The impact of patient choice on survival in chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2018, 52(3): 1800589. doi: 10.1183/13993003.00589-2018
[26] Lankeit M, Krieg V, Hobohm L, et al. Pulmonary endarterectomy in chronic thromboembolic pulmonary hypertension[J]. J Heart Lung Transplant, 2017. doi: 10.1016/j.healun.2017.06.011.
[27] Madani MM, Auger WR, Pretorius V, et al. Pulmonary endarterectomy: recent changes in a single institution's experience of more than 2, 700 patients[J]. Ann Thorac Surg, 2012, 94(1): 97-103. doi: 10.1016/j.athoracsur.2012.04.004
[28] D'armini AM, Morsolini M, Mattiucci G, et al. Pulmonary endarterectomy for distal chronic thromboembolic pulmonary hypertension[J]. J Thorac Cardiovasc Surg, 2014, 148(3): 1005-1011. doi: 10.1016/j.jtcvs.2014.06.052
[29] Hsieh WC, Jansa P, Huang WC, et al. Residual pulmonary hypertension after pulmonary endarterectomy: A meta-analysis[J]. J Thorac Cardiovasc Surg, 2018, 156(3): 1275-1287. doi: 10.1016/j.jtcvs.2018.04.110
[30] Tsuji A, Ogo T, Demachi J, et al. Rescue balloon pulmonary angioplasty in a rapidly deteriorating chronic thromboembolic pulmonary hypertension patient with liver failure and refractory infection[J]. Pulm Circ, 2014, 4(1): 142-147. doi: 10.1086/675643
[31] Collaud S, Brenot P, Mercier O, et al. Rescue balloon pulmonary angioplasty for early failure of pulmonary endarterectomy: the earlier the better?[J]. Int J Cardiol, 2016, 222: 39-40. doi: 10.1016/j.ijcard.2016.07.021
[32] Khan MS, Amin E, Memon MM, et al. Meta-analysis of use of balloon pulmonary angioplasty in patients with inoperable chronic thromboembolic pulmonary hypertension[J]. Int J Cardiol, 2019, 291: 134-139. doi: 10.1016/j.ijcard.2019.02.051
[33] Inami T, Kataoka M, Yanagisawa R, et al. Long-term outcomes after percutaneous transluminal pulmonary angioplasty for chronic thromboembolic pulmonary hypertension[J]. Circulation, 2016, 134(24): 2030-2032. doi: 10.1161/CIRCULATIONAHA.116.024201
[34] Kataoka M, Inami T, Kawakami T, et al. Balloon pulmonary angioplasty (percutaneous transluminal pulmonary angioplasty) for chronic thromboembolic pulmonary hypertension: a Japanese perspective[J]. JACC Cardiovasc Interv, 2019, 12(14): 1382-1388. doi: 10.1016/j.jcin.2019.01.237
[35] Hu S, Tan JS, Liu S, et al. The long-term survival in patients with chronic thromboembolic pulmonary hypertension: experience from a single center in China[J]. J Thromb Thrombolysis, 2022, 53(4): 926-933. doi: 10.1007/s11239-021-02594-1
[36] Taniguchi Y, Miyagawa K, Nakayama K, et al. Balloon pulmonary angioplasty: an additional treatment option to improve the prognosis of patients with chronic thromboem-bolic pulmonary hypertension[J]. EuroIntervention, 2014, 10(4): 518-525. doi: 10.4244/EIJV10I4A89
[37] Simonneau G, D'armini AM, Ghofrani HA, et al. Predictors of long-term outcomes in patients treated with riociguat for chronic thromboembolic pulmonary hypertension: data from the CHEST-2 open-label, randomised, long-term extension trial[J]. Lancet Respir Med, 2016, 4(5): 372-380. doi: 10.1016/S2213-2600(16)30022-4
[38] Ghofrani HA, D'armini AM, Grimminger F, et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension[J]. N Engl J Med, 2013, 369(4): 319-329. doi: 10.1056/NEJMoa1209657
[39] Sadushi-kolici R, Jansa P, Kopec G, et al. Subcutaneous treprostinil for the treatment of severe non-operable chronic thromboembolic pulmonary hypertension (CTREPH): a double-blind, phase 3, randomised controlled trial[J]. Lancet Respir Med, 2019, 7(3): 239-248. doi: 10.1016/S2213-2600(18)30367-9
[40] Kim NH, Papamatheakis DG, Fernandes TM. Evolution of randomized, controlled studies of medical therapy in chronic thromboembolic pulmonary hypertension[J]. Pulm Circ, 2021, 11(2): 20458940211007373.
[41] Ghofrani HA, Simonneau G, D'armini AM, et al. Maciten-tan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1): results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study[J]. Lancet Respir Med, 2017, 5(10): 785-794. doi: 10.1016/S2213-2600(17)30305-3
[42] Ogo T, Shimokawahara H, Kinoshita H, et al. Selexipag for the treatment of chronic thromboembolic pulmonary hypertension[J]. Eur Respir J, 2022, 60(1): 2101694. doi: 10.1183/13993003.01694-2021
[43] Jais X, Brenot P, Bouvaist H, et al. Balloon pulmonary angioplasty versus riociguat for the treatment of inoperable chronic thromboembolic pulmonary hypertension (RACE): a multicentre, phase 3, open-label, randomised controlled trial and ancillary follow-up study[J]. Lancet Respir Med, 2022, 10(10): 961-971. doi: 10.1016/S2213-2600(22)00214-4
[44] Guth S, D'armini AM, Delcroix M, et al. Current strategies for managing chronic thromboembolic pulmonary hyperten-sion: results of the worldwide prospective CTEPH Registry[J]. ERJ Open Res, 2021, 7(3): 00850-2020.
[45] Reesink HJ, Surie S, Kloek JJ, et al. Bosentan as a bridge to pulmonary endarterectomy for chronic thromboembolic pulmonary hypertension[J]. J Thorac Cardiovasc Surg, 2010, 139(1): 85-91. doi: 10.1016/j.jtcvs.2009.03.053
[46] Cannon JE, Su L, Kiely DG, et al. Dynamic risk stratification of patient long-term outcome after pulmonary endarterectomy: results from the united kingdom national cohort[J]. Circulation, 2016, 133(18): 1761-1771. doi: 10.1161/CIRCULATIONAHA.115.019470
[47] Capone C, Valentini A, Spinillo SL, et al. Radiological differences between chronic thromboembolic pulmonary disease (CTEPD) and chronic thromboembolic pulmonary hypertension (CTEPH)[J]. Eur Radiol, 2021, 31(8): 6230-6238. doi: 10.1007/s00330-020-07556-4
[48] Wiedenroth CB, Olsson KM, Guth S, et al. Balloon pulmonary angioplasty for inoperable patients with chronic thromboembolic disease[J]. Pulm Circ, 2018, 8(1): 2045893217753122.
[49] Inami T, Kataoka M, Kikuchi H, et al. Balloon pulmonary angioplasty for symptomatic chronic thromboembolic disease without pulmonary hypertension at rest[J]. Int J Cardiol, 2019, 289: 116-118. doi: 10.1016/j.ijcard.2019.04.080
-
期刊类型引用(1)
1. 侯荣娜,周学良,宋梦瑶,张程智,孙占国,方毅,韩新巍,焦德超. 数字减影血管造影引导下经鞘管内钳夹活检辅助诊断肺动脉梗阻性疾病. 中国介入影像与治疗学. 2024(07): 390-392 .  百度学术
百度学术
其他类型引用(0)

 作者投稿
作者投稿 专家审稿
专家审稿 编辑办公
编辑办公 主编办公
主编办公

 下载:
下载: